 Glioblastomes
Glioblastomes
IX. Récidive
*1. Généralités
Il n’y a pas de consensus concernant la prise en charge de la récidive [139]. La décision doit être discutée en RCP et se base en général sur les traitements déjà reçus par le patient, son âge, son état général (KPS), le délai de récidive et son aspect en imagerie.
*2. Diagnostics différentiels
Il est tout d’abord nécessaire de différencier une récidive tumorale d’une pseudo-progression, ou d’une radionécrose, qui sont les 2 diagnostics différentiels principaux. La pseudo-progression survient habituellement dans les 12 semaines qui suivent la fin de la radiothérapie (cf infra) et évolue favorablement [109,129]. La radionécrose, qui survient dans 7,1 à 9,3% des cas après radio-chimiothérapie concomitante [16,103], est parfois difficile à différencier d’une progression tumorale, tant sur le plan clinique que radiologique. Il s’agirait d’un dysfonctionnement des cellules endothéliales avec augmentation de la perméabilité capillaire et de l’œdème extracellulaire, dans un contexte d’inflammation chronique [149]. Le délai médian de survenu serait de 11 mois [132]. L’IRM de perfusion et la spectroscopie sont considérées comme des outils intéressants mettant en évidence une hypoperfusion (baisse du rCBV) et une baisse du NAA et de la choline. La TEP-TDM au 18FDG ou plus récemment à la 18F-DOPA peut aider au diagnostic (hypofixation de la radionécrose). Toutefois ces examens manquent de sensibilité et de spécificité, en partie car il peut exister d’authentiques récidives tumorales au sein de lésions de radionécrose [17]. Le traitement standard de la radionécrose est la corticothérapie à fortes doses [130]. Les antiagrégants plaquettaires, l’anticoagulation et l’oxygénothérapie hyperbare n’ont pas démontré d’efficacité significative. La chirurgie d’exérèse peut-être une solution si la symptomatologie est évolutive et après échec de la corticothérapie [78]. Plusieurs séries avec de petits effectifs semblent suggérer un effet radiologique et clinique du bévacizumab chez plus de la moitié des patients [68,132].
*3. Prise en charge de la récidive
La première option à discuter chez des patients sélectionnés est celle d’une nouvelle chirurgie [72] (figure 3).
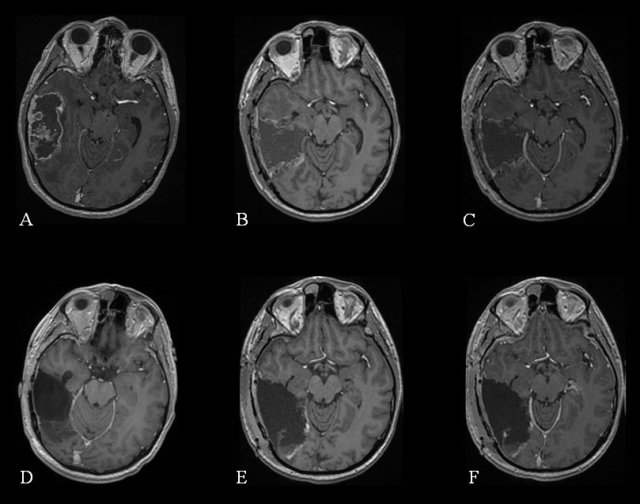
Les considérations sur l’étendue d’exérèse sont les mêmes que lors d’une première chirurgie [88,97].
La chimiothérapie in situ par implants de carmustine est une option à discuter en fonction des habitudes de chaque centre et des conditions opératoires [20,71] et a priori pour une exérèse macroscopiquement complète ou subtotale.
Le rôle d’une nouvelle irradiation est discuté au cas par cas devant le risque de radionécrose. Différents protocoles avec de multiples fractionnements ont été proposés, de 6 doses de 5 Gy à 18 doses de 2 Gy [42,52].
En l’absence de consensus sur la chimiothérapie à la récidive, les schémas thérapeutiques sont variables selon les centres. Globalement, 3 stratégies médicales peuvent être proposées en cas de récidive de glioblastome (recommandations EANO [139]) :![]() i) une chimiothérapie contenant un nitrosourée : fotémustine IV, carmustine IV, bélustine per os. Le taux de réponse est en général faible (entre 10 et 25%) et la toxicité hématologique et pulmonaire est importante (de 20% à 40%) [2,39] ;
i) une chimiothérapie contenant un nitrosourée : fotémustine IV, carmustine IV, bélustine per os. Le taux de réponse est en général faible (entre 10 et 25%) et la toxicité hématologique et pulmonaire est importante (de 20% à 40%) [2,39] ;![]() ii) reprise du témozolomide soit à dose standard, soit sous forme intensifiée [37,93,142]. Cette option parait intéressante lorsque la récidive survient après un délai conséquent après l’arrêt du témozolomide adjuvant ;
ii) reprise du témozolomide soit à dose standard, soit sous forme intensifiée [37,93,142]. Cette option parait intéressante lorsque la récidive survient après un délai conséquent après l’arrêt du témozolomide adjuvant ;![]() iii) bévacizumab en monothérapie ou en association avec une chimiothérapie anticancéreuse (irinotécan, lomustine ou autre). Des études récentes ont rapporté un meilleur taux de réponse (environ 50%) et une prolongation de la survie sans progression à 6 mois (de 19% à 50%) chez les patients traités par bévacizumab, seul ou en association, par rapport aux contrôles historiques sans bévacizumab [26,46]. Par ailleurs, une étude récente de phase II du groupe Italien de Neuro-Oncologie (AINO) n’a pas réussi à démontrer la supériorité d’un traitement combiné bévacizumab+fotémustine par rapport au bévacizumab en monothérapie [122]. Ces résultats sont concordants avec d’autres études rétrospectives [26,99], suggérant l’utilisation préférentiellement du bévacizumab en monothérapie. Le bévacizumab est également reconnu pour le contrôle des symptômes neurologiques et son effet d’épargne de la corticothérapie significatif [139]. L’évaluation de la réponse au bévacizumab est difficile car les réponses cliniques et en imagerie ne sont pas systématiquement corrélées. L’imagerie surestime la réponse au traitement anti-angiogénique en montrant une diminution de la prise de contraste, en rapport avec la diminution de la perméabilité capillaire, alors que l’infiltration tumorale peut ne pas être prise en compte dans l’évaluation. Il est donc nécessaire d’utiliser des critères de réponse radiologique qui prennent en compte l’hypersignal T2/FLAIR (RANO ou RECIST+F, [47]).
iii) bévacizumab en monothérapie ou en association avec une chimiothérapie anticancéreuse (irinotécan, lomustine ou autre). Des études récentes ont rapporté un meilleur taux de réponse (environ 50%) et une prolongation de la survie sans progression à 6 mois (de 19% à 50%) chez les patients traités par bévacizumab, seul ou en association, par rapport aux contrôles historiques sans bévacizumab [26,46]. Par ailleurs, une étude récente de phase II du groupe Italien de Neuro-Oncologie (AINO) n’a pas réussi à démontrer la supériorité d’un traitement combiné bévacizumab+fotémustine par rapport au bévacizumab en monothérapie [122]. Ces résultats sont concordants avec d’autres études rétrospectives [26,99], suggérant l’utilisation préférentiellement du bévacizumab en monothérapie. Le bévacizumab est également reconnu pour le contrôle des symptômes neurologiques et son effet d’épargne de la corticothérapie significatif [139]. L’évaluation de la réponse au bévacizumab est difficile car les réponses cliniques et en imagerie ne sont pas systématiquement corrélées. L’imagerie surestime la réponse au traitement anti-angiogénique en montrant une diminution de la prise de contraste, en rapport avec la diminution de la perméabilité capillaire, alors que l’infiltration tumorale peut ne pas être prise en compte dans l’évaluation. Il est donc nécessaire d’utiliser des critères de réponse radiologique qui prennent en compte l’hypersignal T2/FLAIR (RANO ou RECIST+F, [47]).
 Encyclopædia Neurochirurgica
Encyclopædia Neurochirurgica

