 Glioblastomes
Glioblastomes
IV. Diagnostic
*1. Eléments cliniques
Il existe une grande diversité de symptômes neurologiques, en fonction des zones cérébrales concernées par la tumeur et de son volume. Toutefois il est possible de distinguer 3 grands cadres syndromiques : ![]() déficit neurologique moteur, sensitif, visuel, trouble des fonctions supérieures, cognitives, langagières.
déficit neurologique moteur, sensitif, visuel, trouble des fonctions supérieures, cognitives, langagières. ![]() syndrome d’hypertension intracrânienne (HTIC) : lié à la croissance tumorale, et/ou à une réaction œdémateuse péritumorale importante, ou à un blocage des voies d’écoulement du LCS (liquide cérébro-spinal) entrainant une hydrocéphalie obstructive.
syndrome d’hypertension intracrânienne (HTIC) : lié à la croissance tumorale, et/ou à une réaction œdémateuse péritumorale importante, ou à un blocage des voies d’écoulement du LCS (liquide cérébro-spinal) entrainant une hydrocéphalie obstructive.![]() épilepsie : partielle, secondairement généralisée (valeur « localisatrice » du signal symptôme), ou généralisée d’emblée, elle concerne 20 à 25% des patients avec GBM.
épilepsie : partielle, secondairement généralisée (valeur « localisatrice » du signal symptôme), ou généralisée d’emblée, elle concerne 20 à 25% des patients avec GBM.
Pour être complet, l’examen clinique doit s’attarder à rechercher les éléments suivants : latéralité, niveau d’étude, profession, état neurologique général avec cotation du Performans Status (PS) de l’OMS et/ou de l’indice de Karnofsky (KPS), poids, taille. Les troubles cognitifs peuvent être quantifiés grossièrement par le test Mini Mental Status (MMS) ou, plus récemment, par le Montreal Cognitive Assessment (MoCA). Il est recommandé d’obtenir une évaluation neuropsychologique et langagière avant tout traitement afin de guider la rééducation et d’évaluer l’impact de chaque thérapeutique [61].
Les facteurs cliniques de bon pronostic sont : l’âge (<60 ans), un KPS > 70, l’absence de déficit neurologique et cognitif (MMS ≥ 27), la localisation frontale du GBM [45].
*2. Eléments d’imagerie
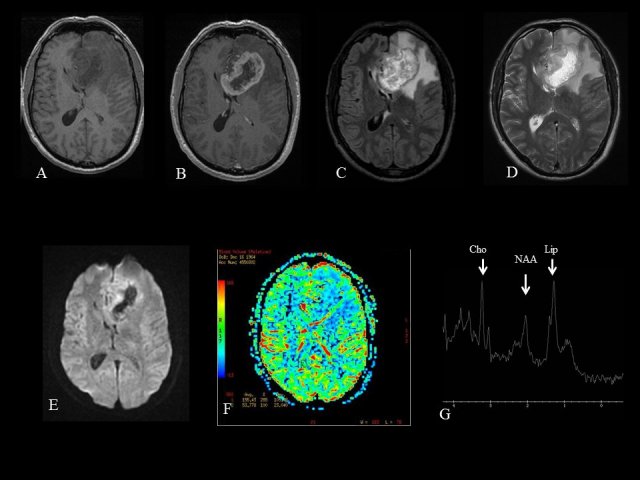
En cas de suspicion de GBM, un scanner sans et avec injection de produit de contraste et surtout une IRM cérébrale « multimodalités » en séquences T1, T1 injectée, T2, FLAIR, diffusion, perfusion et spectroscopie doit être réalisée (figure 1).
- Figure 1
Ces examens vont permettre de :![]() localiser la tumeur et préciser ses rapports avec les structures anatomiques ;
localiser la tumeur et préciser ses rapports avec les structures anatomiques ;![]() évaluer son étendue : unique, multifocal (au moins 2 foyers prenant le contraste indépendants, séparés d’au moins 1 cm), diffus avec envahissement d’au moins 3 lobes cérébraux contigus (gliomatose) ;
évaluer son étendue : unique, multifocal (au moins 2 foyers prenant le contraste indépendants, séparés d’au moins 1 cm), diffus avec envahissement d’au moins 3 lobes cérébraux contigus (gliomatose) ;![]() préciser ses caractéristiques. Classiquement, un GBM possède les caractéristiques suivantes : hypo-iso signal T1, hypersignal T2/FLAIR, prise de contraste périphérique et hétérogène, nécrose centrale, éventuelles portions kystiques, œdème périlésionnel. Les séquences de diffusion apportent un argument supplémentaire à l’encontre d’un abcès, avec une diminution de l’ADC (coefficient apparent de diffusion) car la nécrose centrale est pauci-cellulaire. La perfusion objective des foyers de néo-angiogénèse, le seuil du rCBV (volume sanguin cérébral relatif) retenu est > 2. La spectroscopie ciblée sur la prise de contraste objective un pic de choline (renouvellement membranaire), un pic de lactates et de lipides (nécrose) et une diminution du N-Acétyl Aspartate (témoin de l’intégrité neuronale) par rapport au pic de créatine (pic de référence stable) ;
préciser ses caractéristiques. Classiquement, un GBM possède les caractéristiques suivantes : hypo-iso signal T1, hypersignal T2/FLAIR, prise de contraste périphérique et hétérogène, nécrose centrale, éventuelles portions kystiques, œdème périlésionnel. Les séquences de diffusion apportent un argument supplémentaire à l’encontre d’un abcès, avec une diminution de l’ADC (coefficient apparent de diffusion) car la nécrose centrale est pauci-cellulaire. La perfusion objective des foyers de néo-angiogénèse, le seuil du rCBV (volume sanguin cérébral relatif) retenu est > 2. La spectroscopie ciblée sur la prise de contraste objective un pic de choline (renouvellement membranaire), un pic de lactates et de lipides (nécrose) et une diminution du N-Acétyl Aspartate (témoin de l’intégrité neuronale) par rapport au pic de créatine (pic de référence stable) ;![]() apporter des arguments pour le diagnostic différentiel de toute lésion qui se rehausse après injection de produit de contraste : métastase, abcès, lymphome cérébral, radionécrose, lésion inflammatoire du SNC, foyers de contusion, ischémie ;
apporter des arguments pour le diagnostic différentiel de toute lésion qui se rehausse après injection de produit de contraste : métastase, abcès, lymphome cérébral, radionécrose, lésion inflammatoire du SNC, foyers de contusion, ischémie ;![]() faire le bilan d’éventuelles complications : hémorragie intratumorale, engagement cérébral, hydrocéphalie, méningite tumorale.
faire le bilan d’éventuelles complications : hémorragie intratumorale, engagement cérébral, hydrocéphalie, méningite tumorale.
La tomographie par émission de positons (TEP) avec des traceurs radioactifs (18F-fluorodeoxyglucose, 18F-fluoro-dopa, 18F-fluoroethylthyrosine, ou 11C-methionine) est surtout intéressante et encore en cours d’évaluation dans les situations de récidive tumorale, afin de la différencier d’une radionécrose. Ces techniques ne sont actuellement pas utilisées en routine [102].
*3. Eléments d’anatomo-pathologie et biomarqueurs
La neuro-imagerie ne permettant pas d’être assez spécifique sur le diagnostic de GBM, il est nécessaire de réaliser une analyse histologique de la tumeur [150]. Celle-ci peut être faite à partir d’un échantillon tumoral (biopsie) ou sur la pièce opératoire issue de l’exérèse tumorale.
La classification OMS 2007 classe les GBM dans les tumeurs astrocytaires. Elle distingue : les GBM et leurs variants (GBM à cellules géantes et gliosarcomes), et les GBM avec aspects histologiques particuliers (à petites cellules, avec cellules lipidisées, avec contingent oligodendroglial). Toutefois, cette classification histologique a des limites. Les critères étant subjectifs, elle manque de reproductibilité, avec un taux de discordance intra- et inter-observateur pouvant être important [23,95]. Egalement, elle manque de précision pronostique en raison de l’existence de plusieurs sous-types moléculaires au sein d’un même sous-type histologique. C’est la raison pour laquelle les biomarqueurs prennent une place grandissante dans le diagnostic des GBM, en complément de l’analyse histologique, puisqu’ils semblent avoir une valeur pronostique et prédictive supérieure à la classification morphologique seule (pour revue [144]).
Les marqueurs biologiques couramment recherchés correspondent à la mutation de certains gènes (TP53, IDH1/2, PTEN, EGFRvIII), à des modifications chromosomiques (délétion 10q, 1p, 19q) ou à la dysrégulation épigénétique de certains gènes (méthylation de MGMT). ![]() La mutation du gène TP53 ne constitue pas un facteur pronostic pertinent [86] ;
La mutation du gène TP53 ne constitue pas un facteur pronostic pertinent [86] ;![]() La présence de la mutation d’IDH1 est un facteur important de bon pronostic (survie médiane de 27 à 31 mois vs. 11 à 15 mois sans mutations), mais n’est pas prédictive de la réponse au traitement [85,110,148] ; de plus cette mutation est rare dans les GBM et concerne presque exclusivement les GBM secondaires ;
La présence de la mutation d’IDH1 est un facteur important de bon pronostic (survie médiane de 27 à 31 mois vs. 11 à 15 mois sans mutations), mais n’est pas prédictive de la réponse au traitement [85,110,148] ; de plus cette mutation est rare dans les GBM et concerne presque exclusivement les GBM secondaires ;![]() Le gène PTEN est situé dans le locus 10q23 et code pour une protéine qui joue un rôle dans la prolifération et l’apoptose [58]. Les délétions du bras long du chromosome 10 (10q) sont fréquentes dans les GBM (60%). PTEN est muté dans 15 à 40% des GBM, essentiellement dans les GBM de novo (cf infra). Aucune corrélation n’a été retrouvée entre survie et mutations ou délétions homozygotes de PTEN dans le cas des GBM [86,100,112] ;
Le gène PTEN est situé dans le locus 10q23 et code pour une protéine qui joue un rôle dans la prolifération et l’apoptose [58]. Les délétions du bras long du chromosome 10 (10q) sont fréquentes dans les GBM (60%). PTEN est muté dans 15 à 40% des GBM, essentiellement dans les GBM de novo (cf infra). Aucune corrélation n’a été retrouvée entre survie et mutations ou délétions homozygotes de PTEN dans le cas des GBM [86,100,112] ;![]() La surexpression d’EGFR est retrouvée dans 33 à 100% des GBM [57,86,134]. La forme la plus fréquente est le variant III (EGFRvIII). L’intense expression d’EGFR en immunohistochimie a une valeur diagnostique importante pour les gliomes infiltrants, y compris de haut grade de malignité, avec une sensibilité de 95% et une spécificité de 100% [22]. Le caractère pronostique de l’expression ou de l’amplification d’EGFR a fait l’objet de controverses. Les premières études sur le sujet étaient en faveur d’un plus mauvais pronostic pour les formes surexprimées [117]. D’autres travaux plus récents démontraient une relation entre l’âge et l’amplification d’EGFR. Elle serait un facteur de bon pronostic pour les patients de > 60 ans, et de mauvais pronostic pour les sujets jeunes [11].
La surexpression d’EGFR est retrouvée dans 33 à 100% des GBM [57,86,134]. La forme la plus fréquente est le variant III (EGFRvIII). L’intense expression d’EGFR en immunohistochimie a une valeur diagnostique importante pour les gliomes infiltrants, y compris de haut grade de malignité, avec une sensibilité de 95% et une spécificité de 100% [22]. Le caractère pronostique de l’expression ou de l’amplification d’EGFR a fait l’objet de controverses. Les premières études sur le sujet étaient en faveur d’un plus mauvais pronostic pour les formes surexprimées [117]. D’autres travaux plus récents démontraient une relation entre l’âge et l’amplification d’EGFR. Elle serait un facteur de bon pronostic pour les patients de > 60 ans, et de mauvais pronostic pour les sujets jeunes [11].![]() Les délétions en 1p et/ou 19q sont bien plus rares dans les GBM (0 à 19%) que dans les oligodendrogliomes [11,44]. Aucune étude n’a pu mettre en évidence de relation significative entre le statut 1p ou 19q et la survie ou la chimiosensibilité dans les GBM [11,57].
Les délétions en 1p et/ou 19q sont bien plus rares dans les GBM (0 à 19%) que dans les oligodendrogliomes [11,44]. Aucune étude n’a pu mettre en évidence de relation significative entre le statut 1p ou 19q et la survie ou la chimiosensibilité dans les GBM [11,57].![]() Le gène O6-methyl guanine-DNA methyl transferase (MGMT), localisé en 10q26, code pour une enzyme clé dans les mécanismes de réparation des lésions de l’ADN [38]. La protéine MGMT répare les lésions causées par les agents alkylants dans les cellules tumorales, favorise la survie de ces cellules, et confère à la tumeur une chimiorésistance. Une inhibition de MGMT, le plus souvent par méthylation de son promoteur, empêche cette réparation et rend la tumeur plus chimiosensible. De nombreuses études ont clairement démontré cette relation entre le statut de MGMT et la chimiosensibilité aux alkylants (pour revue [144]). Dans une étude randomisée comparant radiothérapie + témozolomide à la radiothérapie seule [53,126], le délai sans progression et la survie étaient significativement supérieurs dans le groupe traité par témozolomide (respectivement 10,3 vs. 5,3 mois et 21,7 vs. 12,7 mois). Par contre, MGMT ne constitue pas un facteur pronostic indépendant, seulement lorsqu’il est associé à une mutation d’IDH1 [144]. La technique utilisée pour détecter la méthylation de MGMT n’est pas encore standardisée, chacune ayant des avantages et des limites. Pour ne citer que les plus courantes : immunohistochimie (manque de reproductibilité et variabilité inter-observateur), par PCR quantitative (MSP ou Methylation-specific PCR), par MethyLight, par High Resolution Melting (HRM), ou par pyroséquençage. Cependant, le pyroséquençage semble avoir les meilleures valeur prédictive positive et sensibilité. De plus, cette technique serait reproductible et utilisable également sur des échantillons inclus en paraffine, donc plus facilement généralisable [98].
Le gène O6-methyl guanine-DNA methyl transferase (MGMT), localisé en 10q26, code pour une enzyme clé dans les mécanismes de réparation des lésions de l’ADN [38]. La protéine MGMT répare les lésions causées par les agents alkylants dans les cellules tumorales, favorise la survie de ces cellules, et confère à la tumeur une chimiorésistance. Une inhibition de MGMT, le plus souvent par méthylation de son promoteur, empêche cette réparation et rend la tumeur plus chimiosensible. De nombreuses études ont clairement démontré cette relation entre le statut de MGMT et la chimiosensibilité aux alkylants (pour revue [144]). Dans une étude randomisée comparant radiothérapie + témozolomide à la radiothérapie seule [53,126], le délai sans progression et la survie étaient significativement supérieurs dans le groupe traité par témozolomide (respectivement 10,3 vs. 5,3 mois et 21,7 vs. 12,7 mois). Par contre, MGMT ne constitue pas un facteur pronostic indépendant, seulement lorsqu’il est associé à une mutation d’IDH1 [144]. La technique utilisée pour détecter la méthylation de MGMT n’est pas encore standardisée, chacune ayant des avantages et des limites. Pour ne citer que les plus courantes : immunohistochimie (manque de reproductibilité et variabilité inter-observateur), par PCR quantitative (MSP ou Methylation-specific PCR), par MethyLight, par High Resolution Melting (HRM), ou par pyroséquençage. Cependant, le pyroséquençage semble avoir les meilleures valeur prédictive positive et sensibilité. De plus, cette technique serait reproductible et utilisable également sur des échantillons inclus en paraffine, donc plus facilement généralisable [98].
 Encyclopædia Neurochirurgica
Encyclopædia Neurochirurgica

