 Gliomes diffus de bas grade
Gliomes diffus de bas grade
III - HISTOIRE NATURELLE
Les GDBGs affectent le plus souvent des patients jeunes menant une vie familiale, sociale et professionnelle normale. Ces tumeurs sont essentiellement révélées par des crises d’épilepsie (71). Elles sont fréquemment situées au sein ou proches des aires cérébrales dites "éloquentes", à savoir impliquées dans les fonctions sensorimotrices, langagières, visuo-spatiales, mnésiques ou cognitives. Malgré une variabilité intrinsèque du comportement biologique de ces tumeurs, l’histoire naturelle est désormais mieux connue. Il a longtemps été clamé que les GDBG étaient des tumeurs « bénignes », peu voire non évolutives. Des études récentes ont mis en évidence l’évolutivité constante des GDBG en démontrant que ces tumeurs : (i) présentaient une croissance spontanée continue ; (ii) infiltraient le parenchyme cérébral le long des faisceaux de substance blanche, et ce au-delà des anomalies de signal IRM ; (iii) et se transformaient inéluctablement en gliome de haut grade (46,56) (Figure 1). Ainsi, la notion de "bénignité des GDBG" a été abandonnée.
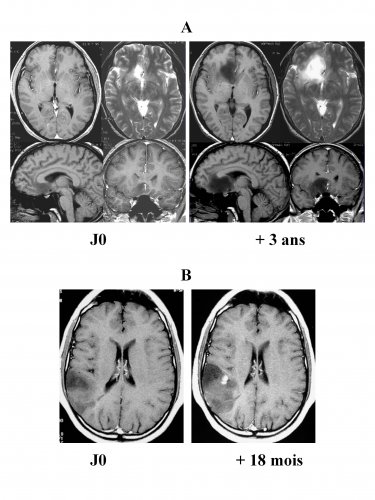
Figure 1 : Histoire naturelle des GDBG
_ A : IRM successives montrant une croissance inéluctable - volume 4 fois plus important 3 ans plus tard chez un patient asymptomatique surveillé.
B : transformation maligne avec apparition d’une prise de contraste 18 mois après la survenue d’une crise d’épilepsie inaugurale chez une patiente non traitée oncologiquement dans l’intervalle.
L’histoire naturelle des GDBG comporte deux périodes principales distinctes : une première phase prémaligne débutant par une période occulte suivie d’une période de visibilité clinique et radiologique ; une deuxième phase pendant laquelle le gliome de grade II subit des modifications génétiques aboutissant à sa transformation maligne en gliome de grade III ou IV selon l’OMS. Au-delà de cette vision dichotomique, qui s’appuie sur une classification histologique trop tranchée, il existe en réalité un continuum entre ces phases évolutives, durant lequel l’acquisition des caractéristiques génotypiques et phénotypiques de malignité est progressive. La difficulté est donc d’apprécier, pour un patient donné et à un instant donné, à quel niveau il se situe dans la transition grade II - grade III/IV (61).
Dans la période prémaligne, une croissance linéaire de l’ordre de 4 mm de diamètre moyen par an (calculée sur 2 IRM successives espacées par au moins 3 mois, selon une méthodologie détaillée dans le chapitre sur l’imagerie), a été retrouvée dans tous les cas, tant chez les patients symptomatiques que dans les GDBG de découverte fortuite (53). De fait, le concept de "survie sans progression" n’a aucune signification dans les GDBG non traités ou à la suite d’une exérèse chirurgicale incomplète, puisque par définition tous les GDBG grossissent continuellement (même si ce concept reste valide à la suite d’une résection totale sur l’IRM ou en cas de stabilisation grâce à une thérapeutique adjuvante par chimiothérapie et/ou radiothérapie). Dans ce contexte, les critères radiologiques classiques, initialement proposés par Mac Donald et plus récemment par le groupe RANO (75) ne sont pas appropriés aux GDBG, puisqu’ils ne se basent que sur calcul de deux diamètres et non sur celui du volume (avec extraction secondaire du diamètre moyen).
Si la « date de naissance » du GDBG n’est que mal connue, de récents modèles biomathématiques ont suggéré l’existence de deux types de gliomes : le premier correspondant à une tumeur apparue durant l’adolescence et de croissance très lente, le second correspondant à une tumeur survenue plus tardivement chez l’adulte jeune (32). Le caractère longtemps asymptomatique des GDBG ainsi que la rareté ou l’extrême discrétion des troubles neurologiques est expliqué par deux mécanismes : (i) l’infiltration du parenchyme cérébral par des cellules tumorales isolées permettant la persistance de tissu fonctionnel au sein de la tumeur ; (ii) la lenteur de l’évolution tumorale autorisant la mise en place d’une adaptation cérébrale par des phénomènes de neuroplasticité à l’origine d’une réorganisation dynamique des réseaux fonctionnels envahis par le gliome (19). Qui plus est, non seulement ces lésions grossissent mais elles migrent également le long des fibres blanches. Par conséquent, le GDBG n’est pas une "masse tumorale" mais une maladie chronique infiltrant progressivement le parenchyme cérébral, en particulier la connectivité sous-corticale. C’est une telle diffusion qui finit par induire des troubles neurocognitifs, du fait (au moins en partie) d’un très probable syndrome de déconnexion (27).
Finalement, les GDBG évoluent de façon inexorable vers la malignité. Cette transformation peut être observée cliniquement et radiologiquement de façon lente ou rapide, soulignant là encore la diversité biologique des GDBG et expliquant la possibilité de les diagnostiquer à des stades intermédiaires (i.e. ne rentrant pas parfaitement dans les grades II ou III/IV selon la classification OMS, mais par exemple correspondant à un grade II avec des foyers d’anaplasie). Les mécanismes exacts impliqués dans la transformation maligne ne sont actuellement pas connus, empêchant de fait de prédire sa survenue à l’échelon individuel, même si des modifications génétiques sont volontiers associées (40). Il est néanmoins exceptionnel d’observer une dégénérescence pour les GDBG de petit volume (inférieur à 10 cc) (4). Cliniquement, les conséquences fonctionnelles d’une telle transformation sont majeures avec apparition et/ou d’une aggravation de l’épilepsie, l’installation de déficits voire d’une hypertension intracrânienne. S’y associent radiologiquement une accélération de la croissance tumorale ainsi qu’une apparition d’une prise de contraste, d’œdème, voire d’effet de masse et de possible nécrose. La mise en jeu du pronostic fonctionnel résulte donc de l’atteinte d’une zone fonctionnelle par trois mécanismes, qui peuvent être combinés : (i) une vitesse de croissance tumorale supérieure aux capacités de plasticité cérébrale ; (ii) une majoration de l’effet de masse sur les zones éloquentes jouxtant le gliome et préalablement recrutées par des phénomènes de neuroplasticité ; (iii) une destruction des réseaux axonaux infiltrés par la tumeur et jusque là préservés.
Cette transformation aboutit dans tous les cas au décès du patient, avec une médiane de survie globale des GDBG de moins de 8 ans. En effet, dans une étude EORTC prospective randomisée portant sur plus de 600 patients, dans le sous-groupe avec un score pronostique favorable, la survie médiane était de 7,7 ans (tandis qu’elle n’était que de 3,2 ans dans le sous-groupe de patients avec un score pronostique défavorable) (57). _ Plus récemment, un travail comparatif entre exérèse chirurgicale et biopsie a montré que la médiane de survie n’était que de 5,8 ans dans le groupe de patients biopsiés (38). Ces données démontrent donc clairement que le pronostic spontané du GDBG est relativement sombre.
 Encyclopædia Neurochirurgica
Encyclopædia Neurochirurgica