 Epilepsie associée aux gliomes infiltrants de l’adulte
Epilepsie associée aux gliomes infiltrants de l’adulte
Mots clés : Épilepsie ; Gliome ; Néocortex ; Pharmacorésistance
I. Définition
La ligue internationale contre l’épilepsie définit la maladie épileptique à partir d’une seule criseépileptique en cas de présence d’un facteur prédisposant à de futures crises (47). Ainsi, chez un patient porteur d’un gliome infiltrant, la survenue d’une seule crise d’épilepsie est synonyme de maladie épileptique.
Définition associée : voir chapitre « Gliomes diffus de bas grade »
II. Historique : à la recherche des sites anatomiques de genèse
Une préoccupation neurochirurgicale essentielle, bien avant de comprendre les mécanismes physiopathologiques sous-jacents, est la localisation des sites anatomiques de genèse responsables de l’épilepsie associée aux gliomes infiltrants.
II.1.Approche clinique électrophysiologique directe per-opératoire
Dès les années 1930, l’approche par électrocorticographie directe per-opératoire a constitué le principal outil pour localiser la tumeur à des fins chirurgicales et pour comprendre l’organisation du réseau épileptogène (8, 44, 49, 51, 96). En 1935, Foerster et Altenburger démontrent pour la première fois que le tissu tumoral des gliomes est électriquement inactif du fait d’une destruction neuronale massive et que des perturbations électriques, à type d’ondes lentes, peuvent être enregistrées au voisinage dela tumeur. La présence d’un silence électrique au centre de la lésion et la possible présence d’anomalies électriques dans leur périphérie sont devenues la règle d’organisation électrophysiologique concernant les gliomes infiltrants (96). Une étude remarquable par transcorticographie per-opératoire avec des enregistrements pluri-unitaires et unitaires effectués sur 22 tumeurs cérébrales a été publiée en 1966 par l’équipe de la Pitié-Salpêtrière (51). Elle confirme qu’un silence électrique, correspondant àune destruction neuronale totale, est presque exclusivement retrouvé en regard d’un envahissement tumoral macroscopique du néocortex et jamais retrouvé en regard d’un néocortex morphologiquement normal. Des tracés discontinus, associant activités en bouffées et silence électrique, sont retrouvés en regard du néocortex sans envahissement macroscopique à la périphérie d’un envahissement tumoral macroscopique. Une activité Delta polymorphe, de rythmicité, d’organisation et d’amplitude variables, est retrouvéeen regard du néocortex macroscopiquement normal. L’équipe de Montréal, dans les années 60, a rapporté des résultats similaires en électrocorticographie per-opératoire de surface chez des patients épileptiques porteurs d’un gliome infiltrant de bas grade :une activité épileptiforme à type de pointes dans le néocortex péri-tumoral et une activité d’ondes lentes rythmique sur la projection tumorale alors même que les circonvolutions cérébrales semblaient macroscopiquement intactes (44). Cette organisation électrique peut être calquée sur l’organisation tumorale avec, du centre de la tumeur à sa périphérie, un silence électrique entouré d’une zone d’activité discontinue entourée d’une zone d’activité Delta polymorphe entourée d’une zone Delta monomorphe correspondant à la décroissance de l’infiltration tumorale (51). Ces constats sont cependant à pondérer par l’organisation spatiale des gliomes infiltrants qui, par définition, ne possèdent pas de limites tumorales nettes (28, 29, 60, 61, 87). L’équipe de Sainte-Anne à Paris a réalisé, dans les années 80, une étude de corrélations électrophysio-anatomo-pathologiques sur une série de 11 patients porteurs d’une épilepsie pharmacorésistante associée à gliome infiltrant en couplant les données de la stéréoélectroencéphalographie et à celles de biopsies stéréotaxiques étagées effectuées le long du trajet des électrodes de stéréoélectroencéphalographie (79). L’équipe de Rennes a rapporté une expérience identique (95). Ces travaux uniques, qui utilisent une approche méthodologique puissante, ont permis de mettre en évidence une activité électrique systématiquement déprimée à type de « silence électrique » au sein du tissu tumoral et des zones anormales à l’imagerie tomodensitométrique, une activité électrique de fond toujours préservée avec ou sans pointes inter-critiques dans le tissu cérébral normal et dans le tissu cérébral siège d’un œdème sans infiltration tumorale et une activité permanente Théta-Delta de haut voltage avec ou sans pointes inter-ictales dans le tissu cérébral siège d’une infiltration tumorale. L’équipe d’Ojemann à Seattle, dans le début des années 90, a corrélé les données de l’électrocorticographie per-opératoire aux anomalies histopathologiques et a rapporté une activité épileptiforme inter-ictale dans le néocortex péri-tumoral qui ne présentait pas d’infiltration tumorale notable mais une gliose modérée à l’analyse histopathologique (8, 49).
II.2 Approche expérimentale sur modèles animaux
Des préparations expérimentales par xénogreffe de lignées de gliomes dans des cerveaux murins ont permis d’étudier plus en détail les sites de genèse des activités épileptiques et leurs liens avec l’infiltration tumorale, avec toutes les limites que ces préparations expérimentales engendrent (16, 17, 63, 110). La stéréoélectroencéphalographie sur l’animal vigil en conditions physiologiques a permis d’enregistrer des activités épileptiformes dans le cortex péri-tumoral, dans les 2 mm entourant la tumeur, mais pas dans la tumeur elle-même (63). L’activité épileptiformeest initiée dans les couches corticales supra-granulaires situées dans la proche périphérie de la tumeur siège d’une infiltration modérée par des cellules tumorales isolées selon une organisation péri-neuronale (17, 63, 110). La propagation des activitésépileptiformes se fait horizontalement dans les couches supra-granulaires du néocortex adjacent (63).
II.3. Approche expérimentale sur modèles humains
II.3.1. Approche morphologique
L’étude histopathologique des prélèvements opératoires de néocortex péri-tumoral siège d’une activité épileptique a confirmé une diminution de l’immunoréactivité à la somatostatine et au GABA sans modification structurelle des interneurones GABAergiques persistants (49, 119, 120, 132). Une étude micro-anatomique réalisée dans le néocortex siège d’une infiltration tumorale gliale a également mis en évidence des anomalies neuronales résultant en une diminution de l’inhibition GABAergique en lien avec l’infiltration tumorale (71, 72). Ces constats suggèrent une diminution de la fonctionnalité de la neurotransmission GABAergique dans ce tissu qui pourrait rendre compte de l’épileptogénicité par défaut d’inhibition.
II.3.2. Approche électrophysiologique
Des enregistrements électrophysiologiques intracellulairesex vivode cellules pyramidales situées dans le néocortex péri-tumoral prélevé au cours de chirurgie de résection ont montré des réponses anormales dans 80% des cas avec perte de l’inhibition fonctionnelle (119, 120). De plus, le néocortex péri-tumoral contient plus de cellulespyramidales déchargeant en bouffées que la tumeur, que la proximité immédiate de la tumeur et que le tissu contrôle qui n’en contient jamais (51, 63).
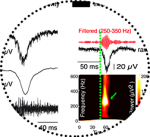
La chirurgie de résection des gliomes infiltrants avec monitorage fonctionnel per-opératoire permet d’obtenir du tissu cérébral avec un degré variable d’infiltration tumorale. Une étude récente a profité de cette opportunité et a mené des enregistrements électrophysiologiques in vitro du cortex cérébral infiltré par des gliomes issus de patients (91). Cette étude montre, pour la première fois, que le néocortex humain autour de gliomes infiltrants, produit spontanément des activités épileptiformes mais pas le néocortex contrôle non tumoral (Figure 1). Des oscillations à haute fréquence (200-250 Hz) sont recueillies dans les sites de genèse de ces activités, signant leur nature épileptique. Ces activités épileptiformes consistent en des décharges synchrones produisant un potentiel de champ, enregistrées dans des segments de néocortex lorsque celui-ci n’est pas macroscopiquement désorganisé par l’infiltration tumorale (0% du tissu tumoral dense, 29% des zones de faible infiltration tumorale et 86% des zones de forte infiltration tumorale) (91). Ces activités épileptiformes sont enregistrées plus fréquemment dans le tissu de patients présentant une épilepsie (77%) que chez ceux n’en présentant pas (27%). Ces activités sont très focales, présentent une synchronie au sein des colonnes corticales, sont initiées préférentiellement dans couches corticales superficielles et ont une propagation restreinte. Elles peuvent être générées en de multiples sites au sein d’une même tranche corticale, les champs de propagation se chevauchant alors parfois.
II.4. Applications pratiques
L’ensemble de ces données expérimentales permet d’identifier le néocortex péri-tumoral, siège d’une infiltration tumorale respectueuse de l’organisation corticale, comme une structure centrale dans la problématique de l’épilepsie associée aux gliomes infiltrants. Il est le siège à la fois d’une infiltration par des cellules tumorales gliales isolées et de la genèse des activités épileptiques au sein de foyers épileptogènes restreints spatialement, uniques ou multiples, et dans les couches corticales superficielles du néocortex.
Le néocortex péri-tumoral est donc d’une importance capitale dans la prise en charge des gliomes infiltrants. Il est, à la croisée des chemins, le lieu : 1) des enjeux fonctionnels où se joue, au cours de la chirurgie de résection, la préservation des aires cérébrales éloquentes ; 2) des enjeux symptomatiques, car il est le siège de la plasticité cérébrale et des premiers signes neurologiques déficitaires lorsque la croissance tumorale dépasse les capacitésde réorganisation plastique ; 3) des enjeux oncologiques, où les gliomes infiltrants mettent à profit leur environnement cérébral immédiat, où les cellules tumorales gliales migrent et se multiplient ; 4) des enjeux mécanistiques impliqués dans la genèse des activités épileptiques.
 Encyclopædia Neurochirurgica
Encyclopædia Neurochirurgica

