 Adénomes hypophysaires
Adénomes hypophysaires
5. Traitements
*5.1 Traitements médicaux
Le prolactinome
Le prolactinome reste une tumeur de prime abord de traitement médical.
Le principe est d’utiliser l’action inhibitrice de la Dopamine via les récepteurs dopaminergiques localisés sur la surface des cellules sécrétant la PRL. L’inhibition produit un défaut de sécrétion avec diminution des vésicules de stockage et donc diminution du volume tumoral. L’action est cytostatique.
Les agonistes dopaminergiques apparaissent à la fin des années 1970 avec le Parlodel® (Bromocriptine, prise quotidienne). La deuxième génération est représentée par le Norprolac® (Quinagolide, prise quotidienne) et la troisième depuis le début des années 2000 par le Dostinex® (Cabergoline, prise hebdomadaire ou quotidienne).
Le Dostinex® est actuellement le traitement de premier choix, sauf en cas de désir de grossesse, car il est plus efficace et mieux toléré que les autres agonistes de la dopamine. Les effets secondaires de ces agonistes sont : l’hypotension artérielle, des troubles digestifs avec nausées, vomissements, surtout à l’induction du traitement. Il est actuellement recommandé de réaliser une échocardiographie annuelle par le laboratoire en raison de la survenue d’atteinte valvulaire.
L’effet anti-sécrétoire et anti-tumoral est rapide, en quelques semaines, avec une chute de la PRL et une diminution de plus de 50% du volume tumoral (figure 7). Cependant, les traitements médicaux cytostatiques devront souvent poursuivi au moins jusqu’à la ménopause. Un sevrage peut être tenté après au moins 3 ans d’hypersécrétion et d’IRM normalisées. Vingt à trente pour cent des patientes ne récidiveraient pas 11,17. Les vraies résistances aux agonistes dopaminergiques sont rares entre 5 et 10%)78.
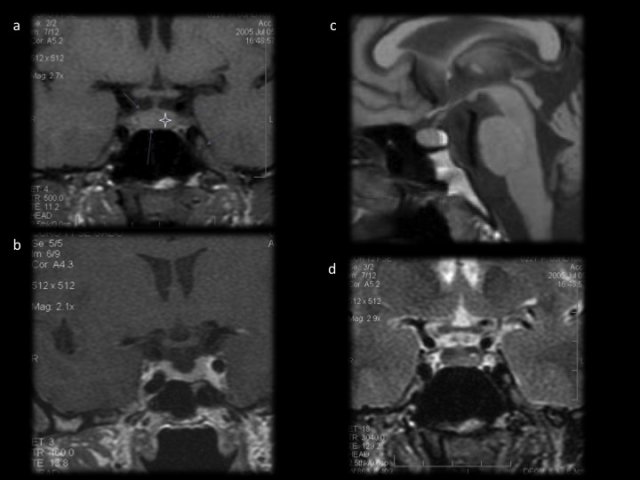
- Figure 7 : a : séquence T1 coronale sans gadolinium ; b : séquence T1 avec gadolinium, l’antéhypophyse se réhausse de façon homogène. c : en sagittal, la posthypophyse apparaît en hypersignal sur les séquences en T1 sans gadolinium. d : Image d’une hypophyse normale en T2 coronale. Les veines caverneuses sont parfaitement visibles.
Particularités de la grossesse :![]() Pour les microadénomes ou « petit » macroadénomes sans proximité avec le chiasma, la fertilité est restaurée dans 90% avec la baisse de l’hyperprolactinémie. En cas de projet de grossesse, un traitement par Parlodel sera préféré en raison de l’ancienneté de ce traitement, mais aucun effet tératogène n’a été relevé pour la cabergoline (Lebbe Clin Endo 2010) 41. Le risque d’augmentation de volume est très faible (<2%) et le traitement est arrêté pendant la grossesse sans surveillance particulière (pas de dosage de la PRL en raison de l’augmentation physiologique gravidique), l’allaitement sera permis. Un bilan biologique et une IRM seront effectués au décours.
Pour les microadénomes ou « petit » macroadénomes sans proximité avec le chiasma, la fertilité est restaurée dans 90% avec la baisse de l’hyperprolactinémie. En cas de projet de grossesse, un traitement par Parlodel sera préféré en raison de l’ancienneté de ce traitement, mais aucun effet tératogène n’a été relevé pour la cabergoline (Lebbe Clin Endo 2010) 41. Le risque d’augmentation de volume est très faible (<2%) et le traitement est arrêté pendant la grossesse sans surveillance particulière (pas de dosage de la PRL en raison de l’augmentation physiologique gravidique), l’allaitement sera permis. Un bilan biologique et une IRM seront effectués au décours. ![]() Pour les macroadénomes, le risque d’augmentation de volume justifie la poursuite du traitement médical pendant la grossesse. La surveillance sera visuelle avec un examen ophtalmologique tous les trimestres et une IRM en cas de signes compressifs. L’allaitement sera contre-indiqué.
Pour les macroadénomes, le risque d’augmentation de volume justifie la poursuite du traitement médical pendant la grossesse. La surveillance sera visuelle avec un examen ophtalmologique tous les trimestres et une IRM en cas de signes compressifs. L’allaitement sera contre-indiqué.
L’algorithme de la figure 14 résume la prise en charge actuelle des prolactinomes.
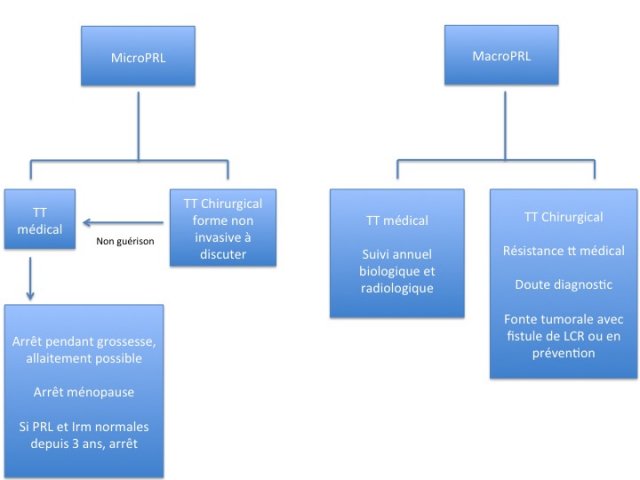
- Figures 14 : algorithme de prise en charge des prolactinomes, adénomes corticotropes et des adénomes hypophysaires non fonctionnels.
L’adénome somatotrope
Les échecs de la chirurgie ou les adénomes de volume moyen ou petit avec envahissement de la loge caverneuse seront traités médicalement (algorithme de prise en charge, figure 4).
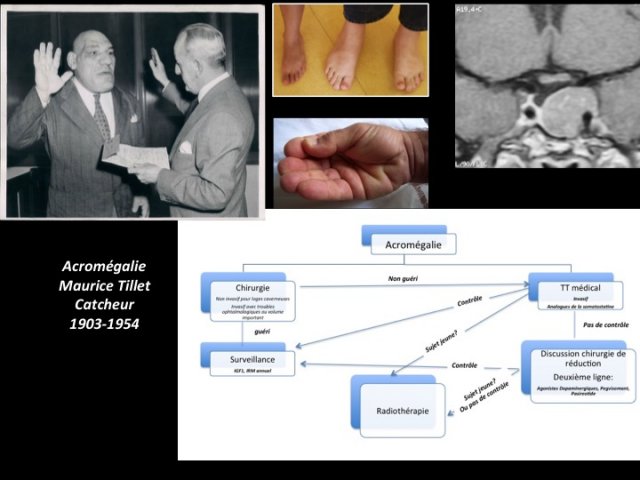
- Figure 4 : photos du syndrome dysmorphique de l’acromégalie. L’algorithme du bas résume la prise en charge actuelle de l’acromégalie où la priorité est donnée à la chirurgie autant que faire se peut.
![]() Les traitements de première ligne sont : les analogues de la somatostatine (AS) de première génération (Octréotide, Lanréotide) agissant sur les récepteurs SST2 présents sur la membrane de la cellule tumorale dans 90% des adénomes somatotropes)16. Ces analogues suppriment la production de GH diminuant ainsi le volume cellulaire et parfois le volume tumoral. L’action est néanmoins cytostatique et par définition les analogues ne guérissent pas les patients. Ce traitement nécessite une injection IM ou sous-cutanée profonde toutes les 4 semaines. Un premier bilan (GH-IGF-1 +/- IRM) sera réalisé à la veille de la 4ème injection afin d’évaluer la sensibilité au traitement et permettre son adaptation. Une augmentation des doses et/ou une augmentation de la fréquence des injections seront discutées en l’absence de contrôle de l’hypersécrétion. Les effets secondaires des traitements sont principalement digestifs, par diminution de la sécrétion d’enzymes pancréatiques avec malabsorption et diarrhées ainsi que les lithiases vésiculaires. La prescription d’enzymes pancréatiques encadrant les injections d’AS permet de soulager les patients et ces effets digestifs s’amenuisent avec le temps. Il convient aussi de prendre en compte les coûts élevés de ces traitements.
Les traitements de première ligne sont : les analogues de la somatostatine (AS) de première génération (Octréotide, Lanréotide) agissant sur les récepteurs SST2 présents sur la membrane de la cellule tumorale dans 90% des adénomes somatotropes)16. Ces analogues suppriment la production de GH diminuant ainsi le volume cellulaire et parfois le volume tumoral. L’action est néanmoins cytostatique et par définition les analogues ne guérissent pas les patients. Ce traitement nécessite une injection IM ou sous-cutanée profonde toutes les 4 semaines. Un premier bilan (GH-IGF-1 +/- IRM) sera réalisé à la veille de la 4ème injection afin d’évaluer la sensibilité au traitement et permettre son adaptation. Une augmentation des doses et/ou une augmentation de la fréquence des injections seront discutées en l’absence de contrôle de l’hypersécrétion. Les effets secondaires des traitements sont principalement digestifs, par diminution de la sécrétion d’enzymes pancréatiques avec malabsorption et diarrhées ainsi que les lithiases vésiculaires. La prescription d’enzymes pancréatiques encadrant les injections d’AS permet de soulager les patients et ces effets digestifs s’amenuisent avec le temps. Il convient aussi de prendre en compte les coûts élevés de ces traitements.![]() L’efficacité est corrélée au volume et à l’hypersécrétion avec en moyenne 50% de répondeurs à un an et 30% de réduction de volume tumoral après ce délai. Bien que l’effet thérapeutique se poursuive avec le temps 44, une réponse insuffisante après 6 mois de traitement doit faire poser la question d’un traitement complémentaire ou d’un changement de stratégie thérapeutique.
L’efficacité est corrélée au volume et à l’hypersécrétion avec en moyenne 50% de répondeurs à un an et 30% de réduction de volume tumoral après ce délai. Bien que l’effet thérapeutique se poursuive avec le temps 44, une réponse insuffisante après 6 mois de traitement doit faire poser la question d’un traitement complémentaire ou d’un changement de stratégie thérapeutique.
Les critères de contrôle sont identiques aux critères de guérison (GH moyenne <2,5 μg/l (7,5 mI/l), IGF1 normale pour l’âge, Nadir GH/HGPO : <0,4μg/l (1,2 mI/l)).![]() Les traitements de deuxième ligne sont :
Les traitements de deuxième ligne sont :
- les agonistes dopaminergiques : ces thérapeutiques sont d’utilisation évidente en cas d’adénome mixte GH-PRL, mais peuvent être utiles, pour traiter des adénomes à GH purs en raison de la présence possible de récepteurs dopaminergiques membranaires. Ils sont utilisés en association avec les AS en cas de maladie non contrôlée, avec élévation modérée de l’IGF1 (<1,3 fois la normale) mais peuvent également être utilisés en première ligne en cas d’acromégalie modérée.
- Le nouvel AS, pasiréotide®, actif sur 4 des 5 récepteurs de la SST est une option de deuxième ligne et les résultats préliminaires montrent qu’il pourrait être plus efficace dans le contrôle de l’hypersécrétion et du volume tumoral et également en cas de résistance aux AS classiques 56.
- En cas d’échec des AS, l’antagoniste de la GH (fixation et blocage des récepteurs à GH hépatique) ou PEGVISOMANT® permet le contrôle d’au moins 70% des patients mais n’exerce aucun effet anti-tumoral. Il est utilisé seul en cas de résistance aux AS ou en association avec les AS en cas de volume tumoral important ou de signes tumoraux gênants type céphalées à raison d’une injection journalière. La surveillance se fait sur les taux d’IGF-1 uniquement avec des bilans hépatiques réguliers (en début de traitement, à 15 jours et tous les 6 mois) et une IRM à 6 mois. Des augmentations de volume ont été décrites à l’initiation des traitements ou à l’arrêt des AS.
L’adénome corticotrope
Sur le plan thérapeutique, l’objectif est de supprimer l’hypersécrétion corticotrope, fusse au prix d’un déficit antéhypophysaire et de traiter les complications.
En cas d’échec de la chirurgie, un traitement médical sera mis en œuvre avec au choix sans consensus les analogues de la somatostatine d’action hypophysaire : pasiréotide® (effets secondaires communs aux analogues de la SMS avec risque de décompensation diabétique) ou les anticortisoliques d’action surrénalienne : OP’-DDD, la métopirone ou le kétonazole avec risque d’hépatite pour les antifongiques. Ce traitement sera mis dans l’attente d’une action thérapeutique pérenne qui sera discutée au cas par cas en RCP hypophysaire : reprise chirurgicale hypophysaire, surrénalectomie bilatérale (parfois associée à une radiothérapie hypophysaire) ou une radiothérapie hypophysaire seule surtout en cas de cible individualisée. Dans ce cas, le traitement médical sera maintenu le temps d’obtention de l’effet de la radiothérapie qui se manifeste entre 12 et 18 mois.
L’algorithme de la figure 15 résume la stratégie de la prise en charge des microcorticotropes.

L’adénome thyréotrope
Le traitement peut être chirurgical ou médical par analogues de la somatostatine et vise à restaurer l’euthyroidisme.
Les séries rapportées de la littérature concernent un petit nombre de patients et aucune conclusion définitive ne peut être donnée.
Les AS sont efficaces dans le contrôle de l’hypersécrétion avec 40% de diminution de volume tumoral car tous les adénomes thyréotropes expriment fortement les récepteurs de sous-type 2 et 5 16. Ces AS se discutent en première option lors d’adénomes de volume moyen sans troubles visuels d’autant qu’il existe un envahissement latéral.
Les adénomes hypophysaires non sécrétants ou non fonctionnels (gonadotropes et « silencieux »)
Aucun traitement médical n’a démontré d’efficacité pérenne malgré quelques articles rapportant quelques résultats avec les agonistes dopaminergiques ou les analogues de la somatostatine 18,19.
La stratégie est donc surtout chirurgicale et résumée par l’algorithme de la figure 16.

Les adénomes atypiques ou carcinomes hypophysaires
Les données sont encore plus rares concernant le Bévacizumab (anti-angiogénique anti-VEGF) (ortiz pituitary 2012) et des anti-mTOR 36,54. Certes, il existe une base physiopathologique avec hyperexpression de facteurs angiogéniques et une activation de la voie PI3K/AKT/m-TOR dans certains adénomes agressifs, mais très peu de patients ont été traités à ce jour 33.
L’apoplexie pituitaire
Le traitement reste sujet à controverse et a fait l’objet d’une conférence de consensus par la société anglaise d’endocrinologie60. Un transfert dans centre de référence hypophysaire est la règle. La controverse porte sur la question « indication chirurgicale ou traitement conservateur » car la littérature est confuse sans étude randomisée. Schématiquement, seront considérés pour un traitement conservateur les patients sans troubles visuels sévères ou en aggravation ni troubles de la vigilance. Les paralysies oculomotrices ne sont pas des indications chirurgicales en l’absence de problème d’AV ou de CV.
 Encyclopædia Neurochirurgica
Encyclopædia Neurochirurgica

